【研究成果】細胞移植による肝臓再生メカニズムを解明 ~ 内在性肝前駆細胞をターゲットにした肝再生誘導治療への展開~
<研究の概要>
札幌医科大学医学部附属フロンティア医学研究所組織再生学部門 助教?市戸 義久らの研究グループ(教授 三高 俊広)は、同大学医学部医化学講座(教授 高橋 素子) と東京医科大学 医学総合研究所 分子細胞治療研究部門 (教授 落谷 孝広)との共同研究で、Galactosamine投与ラット障害肝臓から単離したThy1陽性間葉系細胞を、肝細胞の増殖を抑制した後に肝臓の2/3を切除したラット肝臓に移植すると、移植したドナー細胞が分泌する細胞外小胞(Extracellular vesicles; EVs)に含まれるCytokine-induced neutrophil chemoattractant-2 (CINC-2)が類洞内皮細胞(Sinusoidal endothelial cells; SECs)に対し、Interleukin(IL)-17Bを誘導すること、またmiR-199a-5pを含むEVsが肝臓のマクロファージであるクッパー細胞( Kupfeer cells; KCs)を活性化させることで、レシピエント肝臓に元々存在する肝前駆細胞を活性化させ、肝再生を促進する、という肝再生メカニズムを解明しました。 この研究は文部科学省科学研究費補助金と北海道B型肝炎訴訟オレンジ基金研究助成金のもとで行われたもので、その研究成果は、2023年5月17日付に国際科学誌Stem Cell Research & Therapyのオンライン版で発表されました。
Norihisa Ichinohe* , Naoki Tanimizu, Keisuke Ishigami, Yusuke Yoshioka, Naoki Fujitani, Takahiro Ochiya, Motoko Takahashi and Toshihiro Mitaka*
CINC?2 and miR?199a?5p in EVs secreted by transplanted Thy1+ cells activate hepatocytic
progenitor cell growth in rat liver regeneration
(移植したThy1陽性細胞から分泌されたEVs内のCINC-2とmiR-199a-5pは肝前駆細胞を活性化することで肝再生に寄与する。)
<研究のポイント>
? 障害肝由来のThy1陽性細胞をRetrorsine/Partial Hepatectomy (Ret/PH)モデルに移植すると、ドナー細胞であるThy1陽性細胞が分泌するEVsが、SECsでIL17Bを、KCsでIL25を、肝前駆細胞でIL17rbの発現を誘導することで、レシピエント肝臓に存在する小型肝細胞様前駆細胞(Small hepatocyte-like progenitor cells; SHPCs)の増殖を促進し、肝再生が促進することを過去に報告しました (Ichinohe et al, Stem Cells 2017)。
? Thy1陽性細胞を培養した際の培養液(培養上清: Conditioned medium: CM)を回収し、超遠心法で抽出し
? たEVsに含まれる因子をmicroRNA アレイ及びサイトカインアレイ解析を行い、発現の高い因子を抽出し、microRNAとして6因子、サイトカインとしてはCINC-2とMonocyte chemotactic protein 1 (MCP-1)の2因子を抽出しました。
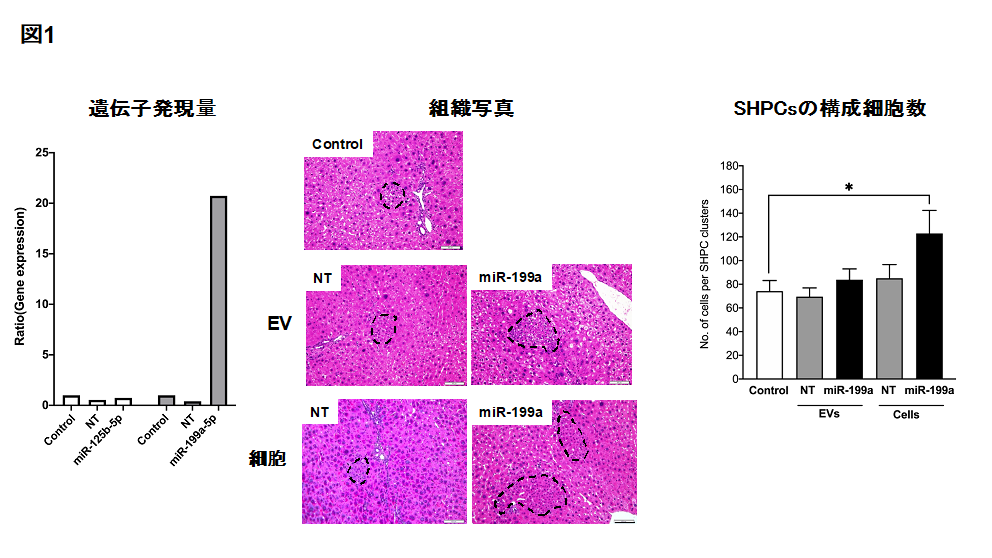
? microRNAを中心に検討したところ、miR-125b-5p とmiR-199a-5pが肝前駆細胞の増植を促進しました。この2因子をThy1陽性細胞に強制発現させると、miR-199a-5p を発現させた細胞にのみ分泌するEVs中に含まれるmiR-199a-5pの量が約20倍高まりました。この強制発現させた細胞と分泌するEVsをRet/PHモデルにそれぞれ移植したところ、細胞を移植した場合においてSHPCsが増大しましたがEVsにはその効果は認められませんでした(図1)。
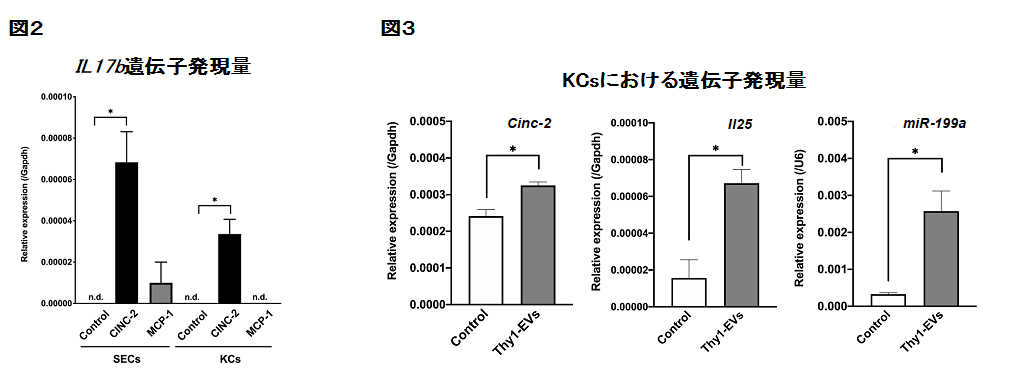
? 次にサイトカインを中心に検討したところ、CINC-2とM C P−1は直接肝前駆細胞の増殖を促進しなかったので、正常ラット肝臓から単離したSE-1陽性SECsとCD68陽性KCsにCINC-2とMCP-1を投与したところ、CINC-2を投与した場合でのみ、IL17bが誘導されました(図2)。またThy1-EVsをCD68陽性KCsに投与すると、miR-199a-5p, Cinc-2, Il25の発現が誘導されました(図3)。
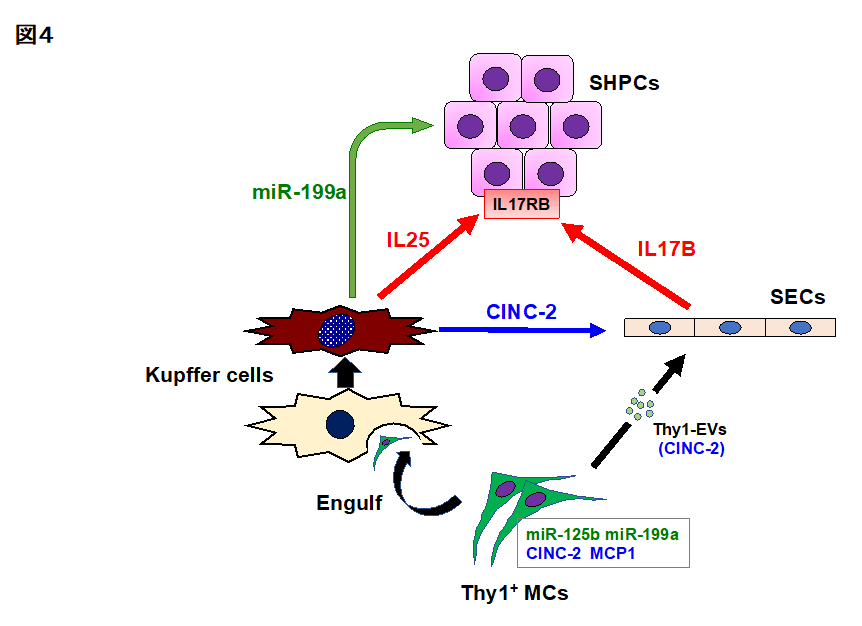
? 以上のことから、① CINC-2を含むThy1陽性細胞由来EVsはSECsに作用してIL17Bを誘導することでIL17RB陽性のSHPCsを増大させる。② 移植したThy1陽性細胞を貪食したKCsは活性化し、CINC-2を誘導することでSECsにおけるIL17B誘導を促進し、かつ③ miR-199a-5pとIL25を誘導し、SHPCsを直接を刺激することで内在性肝前駆細胞を増大させることがわかりました(図4)。
<研究の背景、実施期間など>
肝臓は再生能力の高い臓器として知られており、肝臓の2/3を切除しても、10日程でほぼ元の大きさに回復します。しかしながら、慢性的に障害された肝臓では成熟肝細胞の機能が低下し、再生能力も悪くなります。現在、肝硬変等の致死的肝疾患患者に対して肝臓移植が行われていますが、脳死移植ではドナー不足、生体肝移植では健康なヒトの体にメスを入れる等の様々な問題があります。そこで新しい代替医療として細胞移植による再生医療に期待が寄せられています。これまでの細胞移植では、移植したドナー細胞が、患者の肝臓に生着?増殖し、臓器全体がドナー細胞で置き換わることを主目的としてきました。従って,iPS細胞からの肝細胞創生が注目されますが、これまでの実験で肝細胞移植では生着率が低く、置換されるまでに時間がかかることが問題でした。我々は、従来から肝臓に存在する前駆細胞(小型肝細胞)に着目し、増殖?分化機構の解明と再生誘導治療への応用を一貫して研究してきました。そして2017年に、障害肝由来のThy1陽性細胞をRet/PHモデルに移植すると、ドナー細胞がEVsを分泌し、SECsでIL17Bを、KCsでIL25を、肝前駆細胞でIL17RBの発現を誘導することで、レシピエント肝臓由来のSHPCsの増殖が促進され、肝再生が促進することを過去に報告しました(Ichinohe et al, Stem Cells 2017)。今回、そのThy1-EVsに含まれる再生誘導因子としてCINC-2とmiR-199a-5pを同定し、肝臓を構成するSECsとKCsが内在性肝前駆細胞の増殖を活性化することで肝再生を促進するメカニズムを解明しました。
<研究の意義、これからの可能性、今後への期待、今後の展開など>
従来、細胞移植は、疲弊した肝細胞を新鮮な肝細胞と置換することを目的として行われてきましたが、本研究結果は、移植細胞が放出するEVsがレシピエントの細胞に作用して、内在性の肝前駆細胞の増殖を促進するサイトカインを分泌させるという間接的な効果によって、肝再生を促進していることを示しています。Thy1陽性細胞は肝障害時に出現する細胞ですが、そのThy1陽性細胞の起源とその活性化機序は本研究では明らかになっていませんので、今後さらなる研究を進めていきたいと考えています。最近、細胞間情報伝達物質としてのEVsに関心が集まりつつあり、研究が進んでいます。EV内にはmRNAやmiRNA、lncRNAをはじめ、様々な因子が内包されていることが分かっています。今回、Thy1-EVs内にある肝再生促進因子を同定できたので,肝賦活化薬の開発に繋がることが期待されます。本研究による再生メカニズムの解明は、肝再生医療への臨床応用を後押しするものと考えています。
<本件に関するお問い合わせ先>
所属?職?氏名:札幌医科大学医学部附属フロンティア医学研究所組織再生学部門?助教?市戸義久
TEL:011-611-2111(23910)
FAX: 011-615-3099
E-メール:nichi☆sapmed.ac.jp(☆を@に変えてください)